Solutions documentées
Description
La technique des Solutions documentées consiste à inviter les élèves à résoudre un exercice en suivant les étapes de résolution et en documentant ces étapes. Cette technique se base sur la métacagonition puisqu'elle permet aux élèves de prendre conscience de leurs stratégies de résolution de problèmes en se questionnant sur les étapes à suivre. Les élèves doivent donc résoudre l'exercice en explicitant clairement pourquoi chacune des étapes de résolution est suivie. Ils ne se contentent plus seulement de trouver la bonne réponse. Ils réfléchissent plutôt à leurs apprentissages et mettent en application leur pensée analytique et critique, une compétence essentielle. Cette technique pédagogique est non seulement facile à mettre en place et aisément adaptée à diverses disciplines, mais elle favorise également le développement des compétences de résolution de problèmes des élèves. De plus, elle permet aux enseignants d'avoir une meilleure compréhension du degré d'intégration des concepts par ces derniers. En effet, grâce aux Solutions documentées, les enseignants peuvent plus facilement déceler les erreurs fréquentes ou les incompréhensions liées aux méthodes de résolution de problèmes. Ensuite, ils peuvent rectifier le tir en donnant beaucoup de rétroactions aux élèves.
Procédure
- Choisir un problème ou un exercice qui apparaît comme étant complet et représentatif d'une notion à évaluer de manière formative ou sommative.
- Résoudre le problème soi-même en prenant en note les étapes de résolution ainsi que les raisons expliquant l'importance de chacune d'entre elles.
- Expliquer aux élèves l'activité à réaliser et son utilité en insistant sur le fait que le raisonnement sous-jacent est plus important que l'obtention de la bonne réponse.
- Présenter aux élèves un ou plusieurs exemples de Solutions documentées afin qu'ils aient un modèle sur lequel se baser pour développer la leur.
- Laisser du temps en classe pour que les élèves puissent travailler sur leur Solution documentée.
- Pendant que les élèves travaillent, circuler dans la classe afin de répondre à leurs questions.
- Les élèves peuvent terminer le travail en devoir à la maison ou le remettre à la fin de la séance.
- Corriger les Solutions documentées des élèves en laissant beaucoup de rétroactions sous la forme de commentaires.
- De retour en classe, redonner leur travail aux élèves et, en plénière, revenir sur les erreurs les plus fréquemment commises.
Conseils à donner aux enseignants en lien avec la formule pédagogique
- Cette technique est particulièrement conseillée pour des domaines où la résolution de problèmes est au centre des activités et où il n'est pas toujours évident de comprendre le processus de réflexion des élèves.
- Afin que les élèves puissent pleinenement tirer profit de cette technique pédagogique, il est important de leur en expliquer l'utilité avant de la mettre en place.
- Afin que cette formule soit efficace pédagogiquement, l'enseignant doit présenter des exemples de Solutions documentées aux élèves et leur donner beaucoup de rétroactions sur les leurs.
Exemple d'application
La technique des Solutions documentées a été utilisée dans le cours CHE0501 - Chimie générale offert au programme de l'année préparatoire de Polytechnique Montréal.
Plus particulièrement, l'enseignant fait appel à cette formule pédagogique lors de l'enseignement des notions reliées à la stœchiométrie des réactions chimiques, que les élèves doivent généralement mettre en application dans des exercices de résolution de problèmes. Une fois les notions de ce chapitre enseignées, il réalise avec ses élèves un exercice de Solution documentée, de sorte à ce qu'ils aient un modèle sur lequel se baser lorsque viendra le temps de résoudre un autre exercice par eux-mêmes. L'énoncé de l'exercice en question est le suivant : quelle sera la masse d'eau (H2O) en grammes lorsqu'on fait la combustion de 209 g de méthanol (CH3OH) ?
Afin d'expliciter l'activité des Solutions documentées, l'enseignant remplit avec les élèves un tableau à deux colonnes, soit les étapes de la résolution et l’explication du raisonnement. Le résultat obtenu, une fois le tableau rempli, est le suivant :
| Étapes de la résolution | Explication du raisonnement |
|
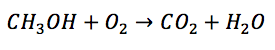
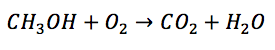

|
|
|

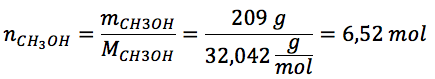
|
|
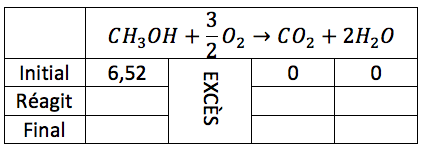 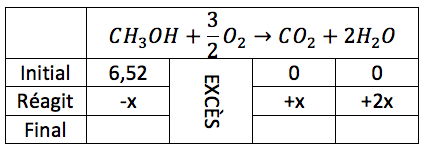 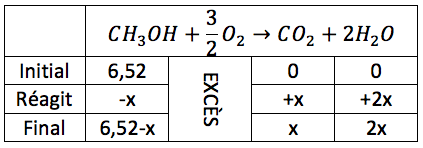
|
|
|

|
|
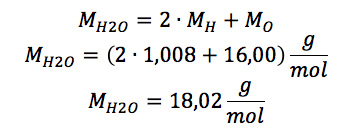
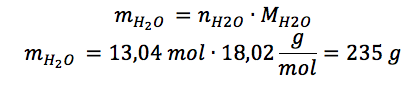
|
|
Une fois cet exercice réalisé, l’enseignant en présente un nouveau portant sur les mêmes notions enseignées aux élèves et leur demande d’en faire la Solution documentée de manière individuelle. Pendant qu’ils travaillent, l’enseignant circule dans la classe afin de répondre aux questions. Si les élèves n’ont pas le temps de terminer le travail demandé avant la fin de la leçon, ils terminent le tout à la maison et remettent leur devoir au début de la leçon suivante. Ensuite, l’enseignant les corrige en laissant beaucoup de commentaires et les remet aux élèves. Il en profite également pour faire un retour en plénière sur l’exercice lors duquel il souligne les erreurs les plus fréquemment commises et revient sur les notions qui semblent être moins bien comprises.
Variante(s)
Si les élèves ont à réaliser une Solution documentée pour la première fois, il est préférable que l'exercice soit réalisé de manière individuelle puisqu'à la base, il s'agit d'un travail de métacognition qui se base sur les processus de réflexion qui sont propres à chaque élève. Par contre, une fois que les élèves sont bien à l'aise avec la formule pédagogique et les notions enseignées, il est possible de les faire travailler en binômes sur une Solution documentée. Cela leur permettra de s'entraider dans la réalisation du travail et favorisera l'enseignement par les pairs.
Source
Angelo, T. Cross, P. (1993). Classroom Assessment Techniques. Jossey-Bass Publishers, 427 pages.


Commenter cette vignette ou proposer un nouvel exemple d'application
Commenter
* champs obligatoire